1- Construccion del Biocombustible:Unos científicos de Wisconsin han informado del descubrimiento de una forma de reducir el coste de la conversión de madera, tallos y hojas de maíz, pasto varilla y otros materiales de biomasa no utilizados como alimentos en combustible etanol. Los investigadores describen su proceso, que reduce cantidad de enzimas costosas necesarias para descomponer la materia fibrosa de la celulosa en biomasa para la fermentación en alcohol, en la 239ª Reunión Nacional de la American Chemical Society (ACS) celebrada en San Francisco, el 25 de marzo.
2- Nitendos en 3d: Nintendo planea sacar al mercado un nuevo modelo de su consola de juegos portátil DS que permitirá a los usuarios disfrutar de juegos en tres dimensiones (3D) sin necesidad de utilizar gafas especiales, con el fin de revitalizar la demanda de esta consola de cinco años antigüedad.
La compañía japonesa señaló que el nuevo modelo, denominado provisionalmente "Nintendo 3DS", será capaz de reproducir los títulos creados para los modelos anteriores de DS y será lanzado al mercado durante el próximo año financiero que comienza en abril.
3- Dispositivo de curacion portatil: A mediados de febrero, un mes después de que un terremoto destruyera gran parte de Port-au-Prince, en Haití, una equipo de tratamiento de heridas del Brigham and Women's Hospital de Boston viajó a la capital devastada. La tarea del equipo era la de ayudar a atender a las decenas de pacientes que sufrían grandes heridas abiertas que acompañan a amputaciones, miembros aplastados y otras lesiones. En el equipo se encontraba la estudiante de postgrado del MIT Danielle Zurovcik, que llegó dispuesta a probar un dispositivo que había desarrollado como parte de su investigación de tesis: una versión barata y portátil de los dispositivos de presión negativa, utilizados actualmente para acelerar la cicatrización de las heridas en los hospitales.
4-Conversion de ague en conbustible: Científicos de la Universidad de Wisconsin-Madison han diseñado un modo de recoger pequeñas cantidades de energía residual y aprovecharlas para convertir el agua en un combustible de hidrógeno utilizable.
El proceso es simple, eficiente y recicla una energía de otro modo desperdiciada.
"Este estudio ofrece una tecnología simple y rentable para la separación directa del agua que puede generar combustibles de hidrógeno aprovechando desechos de energía, como el ruido o las vibraciones del medioambiente", escriben los autores en un nuevo documento, publicado el 2 de marzo en la revista Journal of Physical Chemistry Letters.
5-Metodo para ver atraves de los materiales opacos: Los materiales, como el papel, la pintura y los tejidos biológicos son opacos, porque la luz que pasa a través de ellos se dispersa de forma compleja y aparentemente al azar. Un nuevo experimento realizado por investigadores de la Escuela Superior de Física y Química Industrial de París (ESPCI) ha demostrado que es posible enfocar la luz a través de materiales opacos y detectar objetos ocultos tras ellos, si se sabe lo suficiente sobre el material.
domingo, 15 de abril de 2012
martes, 3 de abril de 2012
Mario Molina
Fue un químico de estados unidos de origen mexicano que recibió el premio nobel de química por sus estudios sobre el ozono en la atmosfera terrestre.
Nació el 19 de marzo de 1943 en la Cd. de México. Estudio ingeniería química en la universidad nacional autónoma de México (la UNAM). Siguió estudiando en Alemania Francia y en 1972 se doctoro en química física por la universidad de california en Berkeley.
En 1974 junto con un amigo de origen estadounidense F. sherwood rowland presento la revista nature trataba de que el cloro contenido en los compuestos CFC (clorofluorocarbonos) se libera en la estratosfera donde provoca la destrucción de la capa de ozono a alturas superiores de 30 km. En 1987 el grupo de científicos dirigidos por molina esclareció el sistema de reacciones químicas que destruyen el ozono en la estratosfera baja. Recibió el premio nobel de química en 1995 junto con Sherwood rowland y el holandés Paul J. Crutzen.
sábado, 24 de marzo de 2012
Teoría el enlace químico. Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes del electromagnetismo. Sin embargo, en la práctica, los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su propia descripción del enlace químico (ver teoría del enlace de valencia). En general, el enlace químico fuerte está asociado con la compartición o transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos -o sea la mayor parte del ambiente físico que nos rodea- está unido por enlaces químicos, que determinan la estructura de la materia.
viernes, 16 de marzo de 2012
catalizadores y consevadores alimenticios
Catalizadore: mantienen que los alimentos no se descompongan,ademas,realizan que el producto no pierda su sabor
conservadores:: Este método nos permite poder consumir alimentos que han sido cosechados y preparados con anterioridad.
conservadores:: Este método nos permite poder consumir alimentos que han sido cosechados y preparados con anterioridad.
lunes, 12 de marzo de 2012
aportaciones de pauling
Las aportaciones más relevantes de Linus Pauling fueron su teoría del enlace químico y su programa de análisis estructural de las macromoléculas biológicas.
En su célebre obra The nature of the chemical bond (1939) explicó en profundidad los enlaces químicos entre átomos y, por tanto, la estructura de las moléculas y sistemas cristalinos, y las propiedades resultantes de las sustancias, sobre la base firme y cuantitativa de la mecánica cuántica recién formulada, impulsando de forma decisiva la química cuántica.
En cuanto a sus hallazgos en el nacimiento de la biología molecular, aplicando las técnicas de la difracción de rayos X, determinó la estructura molecular de diferentes proteínas y estableció el modelo básico de grandes cadenas polipéptidas enrrolladas una en otra a modo de hélice, noción que abrió paso claramente a la hélice de DNA, de la que estuvo muy próximo.
En su célebre obra The nature of the chemical bond (1939) explicó en profundidad los enlaces químicos entre átomos y, por tanto, la estructura de las moléculas y sistemas cristalinos, y las propiedades resultantes de las sustancias, sobre la base firme y cuantitativa de la mecánica cuántica recién formulada, impulsando de forma decisiva la química cuántica.
En cuanto a sus hallazgos en el nacimiento de la biología molecular, aplicando las técnicas de la difracción de rayos X, determinó la estructura molecular de diferentes proteínas y estableció el modelo básico de grandes cadenas polipéptidas enrrolladas una en otra a modo de hélice, noción que abrió paso claramente a la hélice de DNA, de la que estuvo muy próximo.
aportaciones de lewis y pauling
Gilbert Lewis
Luego de obtener su Ph.D. (Doctorado) permaneció como instructor durante un año antes de viajar con una beca, estudiando con el físico químico Wilhelm Ostwald en Leipzig y Walter Nernst en Gotinga. Retornó a Harvard donde permaneció tres años más, y en 1904 la abandonó para ocupar el cargo de superintendente de pesos y medidas en la Oficina de ciencia de las Islas Filipinas, Manila.
Al año siguiente retornó a Cambridge, cuando el Instituto Tecnológico de Massachusetts (MIT) le propuso unirse a un grupo dedicado a la físico química dirigido por Arthur Amos Noyes. En 1907 pasó a desempeñarse como profesor asistente, en 1908 como profesor adjunto y en 1911 como profesor titular. En 1912 dejó el MIT para desempeñarse como profesor de físico química y Decano del Colegio de química en la Universidad de California.
En 1908 publicó el primero de varios artículos sobre la Teoría de la relatividad, en el cual dedujo la relación masa-energía por un camino distinto que Einstein.
En 1916 formuló la idea que un enlace covalente consiste en un par de electrones compartidos y creó el término molécula impar cuando un electrón no es compartido. Sus ideas fueron desarrolladas por Irving Langmuir y sirvieron de inspiración para los estudios de Linus Pauling.
Además, en ese año enunció la importante Regla del octeto.
En 1919, estudiando las propiedades magnéticas de soluciones de oxígeno en nitrógeno líquido, encontró que se había formado una molécula de O4. Esta fue la primera evidencia del oxígeno tetraatómico.
En 1923, formuló la teoría del par electrónico para las reacciones ácido - base.
Por el trabajo de J. Willard Gibbs era conocido que las reacciones químicas tienden a un equilibrio determinado por la energía libre de las sustancias intervinientes. Lewis dedicó 25 años a determinar la energía libre de varias sustancias y en 1923 él y Merle Randall publicaron los resultados del estudio y formalizaron la química termodinámica.
En 1926 acuñó el término "fotón" para la menor unidad de energía radiante.
Lewis fue el primero en producir una muestra pura de óxido de deuterio (agua pesada) en 1933. Acelerando deuterones en el ciclotrón de Ernest Lawrence pudo estudiar muchas de las propiedades de los nucleones.
En los últimos años de su vida probó que la fosforescencia de las moléculas orgánicas obedece a un estado trillizo excitado y midió sus propiedades magnéticas.
Publicó muchos artículos sobre los temas mencionados y otros, desde los cuantos de luz hasta la economía de la estabilización de precios.
Linus Pauling:
Al inicio de la década de 1930, Pauling comenzó a publicar sus investigaciones sobre la naturaleza del enlace químico, lo que llevó a la edición de su famoso libro de texto The Nature of the Chemical Bond, publicado en 1939
El 16 de septiembre de 1952, Linus Pauling comenzó una nueva bitácora de investigación con las palabras "He decidido tratar el problema de la estructura del núcleo". Trece años después, Pauling publicó su modelo de Esfera Empacada en las revistas Science y Proc. Natl. Acad. Sci. Durante las siguientes tres décadas, Pauling continuó publicando artículos basados en dicho modelo.
En noviembre de 1949, junto con Harvey Itano, S. J. Singer e Ibert Wells, Pauling publicó en la revista Science la primera prueba de la relación entre una enfermedad humana y un cambio en una proteína específica.Utilizando la electroforesis, demostraron que la hemoglobina se había modificado en enfermos de anemia falciforme, y que pacientes que eran propensos a este tipo de anemia, sin haberla desarrollado, tenían dos tipos de hemoglobina, modificada y sin modificar. Esta publicación fue la primera demostración de que una proteína específica podía estar asociada con una enfermedad en el ser humano, de manera que la herencia podía influir en las mutaciones de dicha proteína, marcando así los albores de la genética molecular.
Tambien estuvo ayudando a lo que es el automovil electrico y al estudio de medicinas y vitaminas
Luego de obtener su Ph.D. (Doctorado) permaneció como instructor durante un año antes de viajar con una beca, estudiando con el físico químico Wilhelm Ostwald en Leipzig y Walter Nernst en Gotinga. Retornó a Harvard donde permaneció tres años más, y en 1904 la abandonó para ocupar el cargo de superintendente de pesos y medidas en la Oficina de ciencia de las Islas Filipinas, Manila.
Al año siguiente retornó a Cambridge, cuando el Instituto Tecnológico de Massachusetts (MIT) le propuso unirse a un grupo dedicado a la físico química dirigido por Arthur Amos Noyes. En 1907 pasó a desempeñarse como profesor asistente, en 1908 como profesor adjunto y en 1911 como profesor titular. En 1912 dejó el MIT para desempeñarse como profesor de físico química y Decano del Colegio de química en la Universidad de California.
En 1908 publicó el primero de varios artículos sobre la Teoría de la relatividad, en el cual dedujo la relación masa-energía por un camino distinto que Einstein.
En 1916 formuló la idea que un enlace covalente consiste en un par de electrones compartidos y creó el término molécula impar cuando un electrón no es compartido. Sus ideas fueron desarrolladas por Irving Langmuir y sirvieron de inspiración para los estudios de Linus Pauling.
Además, en ese año enunció la importante Regla del octeto.
En 1919, estudiando las propiedades magnéticas de soluciones de oxígeno en nitrógeno líquido, encontró que se había formado una molécula de O4. Esta fue la primera evidencia del oxígeno tetraatómico.
En 1923, formuló la teoría del par electrónico para las reacciones ácido - base.
Por el trabajo de J. Willard Gibbs era conocido que las reacciones químicas tienden a un equilibrio determinado por la energía libre de las sustancias intervinientes. Lewis dedicó 25 años a determinar la energía libre de varias sustancias y en 1923 él y Merle Randall publicaron los resultados del estudio y formalizaron la química termodinámica.
En 1926 acuñó el término "fotón" para la menor unidad de energía radiante.
Lewis fue el primero en producir una muestra pura de óxido de deuterio (agua pesada) en 1933. Acelerando deuterones en el ciclotrón de Ernest Lawrence pudo estudiar muchas de las propiedades de los nucleones.
En los últimos años de su vida probó que la fosforescencia de las moléculas orgánicas obedece a un estado trillizo excitado y midió sus propiedades magnéticas.
Publicó muchos artículos sobre los temas mencionados y otros, desde los cuantos de luz hasta la economía de la estabilización de precios.
Linus Pauling:
Al inicio de la década de 1930, Pauling comenzó a publicar sus investigaciones sobre la naturaleza del enlace químico, lo que llevó a la edición de su famoso libro de texto The Nature of the Chemical Bond, publicado en 1939
El 16 de septiembre de 1952, Linus Pauling comenzó una nueva bitácora de investigación con las palabras "He decidido tratar el problema de la estructura del núcleo". Trece años después, Pauling publicó su modelo de Esfera Empacada en las revistas Science y Proc. Natl. Acad. Sci. Durante las siguientes tres décadas, Pauling continuó publicando artículos basados en dicho modelo.
En noviembre de 1949, junto con Harvey Itano, S. J. Singer e Ibert Wells, Pauling publicó en la revista Science la primera prueba de la relación entre una enfermedad humana y un cambio en una proteína específica.Utilizando la electroforesis, demostraron que la hemoglobina se había modificado en enfermos de anemia falciforme, y que pacientes que eran propensos a este tipo de anemia, sin haberla desarrollado, tenían dos tipos de hemoglobina, modificada y sin modificar. Esta publicación fue la primera demostración de que una proteína específica podía estar asociada con una enfermedad en el ser humano, de manera que la herencia podía influir en las mutaciones de dicha proteína, marcando así los albores de la genética molecular.
Tambien estuvo ayudando a lo que es el automovil electrico y al estudio de medicinas y vitaminas
Biografia de lewis y pauling
Gilbert Newton Lewis
Químico norteamericano. Se graduó en química en la universidad de Harvard y luego marchó a Alemania, donde permaneció durante dos años, transcurridos los cuales fue contratado por el gobierno de Filipinas. A su vuelta a los Estados Unidos comenzó a trabajar en el Instituto de Tecnología de Massachusetts y más tarde como profesor de la Universidad de California.
A pesar de sus numerosas investigaciones dentro del campo científico, Lewis se hizo especialmente famoso por su teoría sobre los enlaces químicos y por su definición de ácido y base. En 1916 Lewis promulgó una teoría sobre determinados enlaces químicos denominados "enlaces covalentes", que se generan entre elementos no metálicos que presentan cuatro o más electrones de valencia, sin llegar a ocho. Las investigaciones de Lewis serían profundizadas y divulgadas por Langmuir alrededor de 1923.
Esta teoría se basaba en el ordenamiento de los electrones en torno al núcleo. Para el hidrógeno, que como máximo puede tener dos electrones rodeando al núcleo, el enlace entre dos átomos resultaba de la compartición de un par de electrones que son aportados por los dos átomos. Según Lewis, las teorías del enlace covalente para el átomo de hidrógeno eran válidas y generalizables para el resto de los átomos. Los átomos multielectrónicos pueden compartir electrones de valencia para formar enlaces covalentes y completar su octete electrónico. El enlace covalente puede ser sencillo, si los átomos sólo comparten un par, doble si comparten dos pares de electrones, y triple si son tres pares los compartidos. También entre átomos diferentes se pueden formar estos enlaces, respetando siempre la regla del octete.
Los fundamentos de la teoría de Lewis sobre los ácidos y las bases ya habían sido establecidos en 1923, pero las ideas permanecieron latentes hasta que fueron enunciadas de nuevo en 1938 por este profesor y difundidas por sus discípulos. Según esta teoría, ácido es cualquier molécula, radical o ión en el cual la agrupación electrónica normal (en general ocho electrones en el nivel más externo) alrededor de uno de sus átomos está incompleta. El átomo puede aceptar así un par o varios pares electrónicos.
PAULING
Químico y físico estadounidense conocido por sus investigaciones sobre la estructura de las moléculas y el enlace químico.
Estudió en la universidad estatal de Oregón y en el Instituto Tecnológico de California. Comenzó a aplicar sus intuiciones en la física cuántica como profesor de química en Oregón, en donde realizó muchos de sus descubrimientos desde 1927 hasta 1964. Por medio de la invención de técnicas como las de los rayos X y la difracción del electrón, pudo calcular las distancias interatómicas y los ángulos entre los enlaces químicos.
Durante la década de 1930, Pauling introdujo conceptos que ayudaron a revelar las fuerzas de enlace de las moléculas. La naturaleza del enlace químico,obra que escribió como resultado de estas investigaciones, ha sido de una influencia fundamental en el pensamiento científico desde su publicación en 1939. Pauling también investigó la estructura atómica de las proteínas (incluyendo la hemoglobina) y descubrió que la deformidad de las células en la anemia falciforme, se produce por un defecto genético que influye en la producción de hemoglobina. Por este trabajo recibió en 1954 el Premio Nobel de Química. En los años siguientes Pauling luchó firmemente contra las pruebas nucleares, advirtiendo públicamente de los peligros biológicos de las precipitaciones radiactivas en la atmósfera, y presentó un escrito sobre este tema a las Naciones Unidas en 1958, firmado por más de 11.000 científicos. En 1962 recibió el Premio Nobel de la Paz, siendo la segunda persona (con Marie Curie) que recibía dos premios Nobel.
A lo largo de su carrera científica, Pauling siguió sus presentimientos creativos sin tener en cuenta las controversias que pudieran provocar. En 1970, por ejemplo,defendió el uso de grandes dosis de vitamina C para tratar el resfriado común, una teoría que muy pocas autoridades médicas han respaldado.
te0ria del 0cteto
La regla del octeto, enunciada en 1917 por Gilbert Newton Lewis, dice que la tendencia de los átomos de los elementos del sistema periódico es completar sus últimos niveles de energía con una cantidad de 8 electrones de tal forma que adquiere una configuración muy estable. Esta configuración es semejante a la de un gas noble,1 los elementos ubicados al extremo derecho de la tabla periódica. Los gases nobles son elementos electroquímicamente estables, ya que cumplen con la estructura de Lewis, son inertes, es decir que es muy difícil que reaccionen con algún otro elemento. Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos enlaces determinará el comportamiento y las propiedades de las moléculas. Estas propiedades dependerán por tanto del tipo de enlace, del número de enlaces por átomo, y de las fuerzas intermoleculares.
lunes, 5 de marzo de 2012
transferencia de electrones
Reacciones de transferencia de electrones
Todos sabemos que los metales expuestos al aire acaban deteriorándose. Tal deterioro es el resultado de la reacción con el oxígeno del aire, a la que denominamos oxidación. Pero no todos los metales se oxidan con igual facilidad. El plomo, por ejemplo, es mucho más resistente a la oxidación que el hierro. Por dicha razón, las fuentes de muchos jardines están hechas de plomo. Hay otros metales aún más resistentes que el plomo, pero también más caros.
Los fuegos artificiales constituyen una tradición con siglos de antigüedad. Un proceso pirotécnico es, fundamentalmente, una combustión; es decir, una reacción del oxígeno con un combustible que produce destellos de color.
Las reacciones que implican transferencia de electrones entre especies reaccionantes se denominan de oxidación-reducción o, abreviadamente, reacciones redox.
Ni los equilibrios ácido-base, ni los de precipitación son reacciones redox. Sin embargo, la mayoría de las reacciones químicas son procesos redox.
Ejemplos destacados de reacciones redox son la fotosíntesis, la respiración, las pilas, los procesos de recubrimientos brillantes y duraderos en las piezas de los automóviles, y en joyería, etc…
viernes, 2 de marzo de 2012
¿Qué une los átomos?
Los átomos se une por una fuerza de electricidad, cuando se unen forman una molecula de elctricidad neutra esto es por qué tienen un solo tipo de átomo y cuando tienen dos átomos iguales o dos que no son iguales se forma una compuesta cuando estos estan muy juntos pero muy juntos entonces la materia es solida y si entre los átomos hay distancia y no estan tan juntos entonces la materia es liquida y por ultimo cuando se encuentran muy pero muy pero muy separados entonces la materia es gaseosa.
jueves, 2 de febrero de 2012
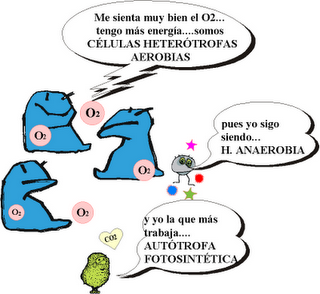
anaerobio y aerobio
Anaerobio, organismo que puede vivir sin oxígeno. Los organismos anaerobios disponen de un metabolismo que produce energía a partir de nutrientes que carecen de oxígeno, habitualmente a través de procesos de fermentación, aunque en ocasiones, como en el caso de los que habitan en las profundas grietas hidrotermales marinas, lo hacen mediante reacciones que emplean compuestos químicos inorgánicos. Todos los anaerobios son organismos simples, como las levaduras y las bacterias; aquellos organismos que mueren en presencia de oxígeno se denominan anaerobios estrictos, mientras que el resto se conocen con el nombre de anaerobios facultativos.
AEROBIO
organismo que sólo puede desarrollarse en presencia de oxígeno atmosférico, del que precisa para la respiración. La atmósfera puede ser aérea o subacuática, ya que existe aire disuelto dentro de las masas de agua (los peces son organismos aerobios que respiran aire disuelto). La atmósfera aérea contiene, al menos, 20 veces más oxígeno que la acuática, lo que condiciona el diseño de los órganos respiratorios de los animales de vida aérea o acuática.
La fotosíntesis
Fotosíntesis, proceso en virtud del cual los organismos con clorofila, como las plantas verdes, las algas y algunas bacterias, capturan energía en forma de luz y la transforman en energía química. Prácticamente toda la energía que consume la vida de la biosfera terrestre —la zona del planeta en la cual hay vida— procede de la fotosíntesis.
Una ecuación generalizada y no equilibrada de la fotosíntesis en presencia de luz sería: CO2 + 2H2A → (CH2) + H2O + H2AEl elemento H2A de la fórmula representa un compuesto oxidable, es decir, un compuesto del cual se pueden extraer electrones; CO2 es el dióxido de carbono; CH2 una generalización de los hidratos de carbono que incorpora el organismo vivo. En la gran mayoría de los organismos fotosintéticos, es decir, en las algas y las plantas verdes, H2A es agua (H2O); pero en algunas bacterias fotosintéticas, H2A es anhídrido sulfúrico (H2S). La fotosíntesis con agua es la más importante y conocida y, por tanto, será la que tratemos con detalle.
Una ecuación generalizada y no equilibrada de la fotosíntesis en presencia de luz sería: CO2 + 2H2A → (CH2) + H2O + H2AEl elemento H2A de la fórmula representa un compuesto oxidable, es decir, un compuesto del cual se pueden extraer electrones; CO2 es el dióxido de carbono; CH2 una generalización de los hidratos de carbono que incorpora el organismo vivo. En la gran mayoría de los organismos fotosintéticos, es decir, en las algas y las plantas verdes, H2A es agua (H2O); pero en algunas bacterias fotosintéticas, H2A es anhídrido sulfúrico (H2S). La fotosíntesis con agua es la más importante y conocida y, por tanto, será la que tratemos con detalle.
miércoles, 1 de febrero de 2012
Nuevos Combustibles
NUEVOS COMBUSTIBLES
Los nuevos combustibles son aquellos en los cuales ya no están necesario la gasolina hay combustibles que están hechos para cuidar el medio ambiente si ya sea nuevos vehículos que son especialmente para que solo funcionen con combustibles como el agua, uno que no haga humo cuando lo eches a rundar como es el caso de los combustibles sintéticos: Estos son los gaseosos o líquidos producidos por el carbón un método para crear el combustible es aquel en el que el carbón se pulveriza y se mezcla con oxígeno y vapor de agua a altas temperaturas y a continuación se purifica; 2) la carbonización o calentamiento del carbón en ausencia de aire; 3) la extracción, que consiste en disolver el carbón en un líquido orgánico y exponerlo a hidrógeno; y 4) la hidrogenación, en la que se combina el carbón con hidrógeno a alta presión, generalmente por la acción de un catalizador. Una tonelada de carbón puede producir 340 metros cúbicos de gas mediante el método de síntesis; con los otros métodos puede producir tres barriles de petróleo.
Esta nueva forma de cuidar el medio ambiente es algo fantástico pues gracias a estos avances tecnológicos podemos seguir protegiendo a nuestro planeta tierra.
martes, 31 de enero de 2012
Examén parcial
Explica ¿Cual es la clasificación de las sustancias?
PURAS E IMPURAS: Por qué muchas de las sustancias estan con otras sustancias
y asi como las que no tienen ninguna sustancia como el agua que es pura.
¿Cuales son los componentes del átomo y explica su carga y función dentro de la organización de la tabla periodica?
ELECTRONES PROTONES Y NEUTRONES
Los electrones sirven para los enlaces
Los protones para el numero átomico
y los neutrones y protones para calcular la masa
¿Cual es el enunciado que explica la ley de la conservación de la masa e interpreta con tus palabras?
LA MASA DEL REACTIVO DEBE SER IGUAL ALA MASA TOTAL DEL PRODUCTO
Esto quiere decir que por ejemplo la leche y el pan la leche pesa 500ml y el pan 100g entonces la masa total del estas 2 cosas son 600g
PURAS E IMPURAS: Por qué muchas de las sustancias estan con otras sustancias
y asi como las que no tienen ninguna sustancia como el agua que es pura.
¿Cuales son los componentes del átomo y explica su carga y función dentro de la organización de la tabla periodica?
ELECTRONES PROTONES Y NEUTRONES
Los electrones sirven para los enlaces
Los protones para el numero átomico
y los neutrones y protones para calcular la masa
¿Cual es el enunciado que explica la ley de la conservación de la masa e interpreta con tus palabras?
LA MASA DEL REACTIVO DEBE SER IGUAL ALA MASA TOTAL DEL PRODUCTO
Esto quiere decir que por ejemplo la leche y el pan la leche pesa 500ml y el pan 100g entonces la masa total del estas 2 cosas son 600g
martes, 17 de enero de 2012
viernes, 6 de enero de 2012
Métodos científicos (DESCRIPCIONES) XD :)
Por proceso o "método científico" se entiende aquellas prácticas utilizadas y ratificadas por la comunidad científica como válidas a la hora de proceder con el fin de exponer y confirmar sus teorías. Las teorías científicas, destinadas a explicar de alguna manera los fenómenos que observamos, pueden apoyarse o no en experimentos que certifiquen su validez. Sin embargo, hay que dejar claro que el mero uso de metodologías experimentales, no es necesariamente sinónimo del uso del método científico, o su realización al 100%. Por ello, Francis Bacon definió el método científico de la siguiente manera:
- Observación: Observar es aplicar atentamente los sentidos a un objeto o a un fenómeno, para estudiarlos tal como se presentan en realidad, puede ser ocasional o causalmente.
- Inducción: La acción y efecto de extraer, a partir de determinadas observaciones o experiencias particulares, el principio particular de cada una de ellas.
- Hipótesis: Planteamiento mediante la observación siguiendo las normas establecidas por el método científico.
- Probar la hipótesis por experimentación.
- Demostración o refutación (antítesis) de la hipótesis.
- Tesis o teoría científica (conclusiones).
Suscribirse a:
Entradas (Atom)






.jpg)